杨懿1,2,万德友2,刘蕴慧2,冯红茹2,杨利2,高新2,宋海峰1,2
1.安徽医科大学,安徽合肥230032;2.军事医学科学院放射与辐射医学研究所,北京100850
[摘要] 目的:在真核细胞中融合表达胰高血糖素样肽1( GLP-1),纯化后探究产物的生物学活性。方法:通过预留酶切位点将合成的CLP-1-IgG2σ F c融合蛋白表达序列连入表达载体质粒,用电转方法将线性化质粒稳定转染CHO-K1细胞,通过亚克隆筛选出蛋白高表达细胞株;收集高表达细胞株培养上清并初步纯化,采用口服葡萄糖耐量试验( OGTT)探究GLP-1融合蛋白降低血糖的生物学活性。结果:经过一轮亚克隆,筛选得到的细胞株的GLP-1融
合蛋白产量达1g/L,OCJTT实验结果表明CLJP-1融合蛋白具有降血糖生物活性。结论:GLP-1变体和IgG2σ的F c段连接是一种可行的融合蛋白形式,融合蛋白具有GLP-1受体激动剂的降糖作用,并且细胞株的筛选方式和初步纯化方法也具有可行性,为后续的体内、外活性研究和纯化方法确定提供了基础。
[关键词] 胰高血糖素样肽1;受体激动剂;融合蛋白;真核表达;口服葡萄糖耐量试验
[中图分类号] Q78; Q25[文章编号] 1009-0002( 2016)02-0173-05
胰高血糖素样肽1(glucagon like peptide-l,GLP-1)是由胰高血糖素原基因编码的一种肠促胰岛素激素,由肠道L细胞在接受进食刺激后合成分泌。基于其血糖依赖性的促进胰岛素分泌作用和抑制胰高血糖素释放作用,GLP-1成为一种极具潜力的糖尿病治疗药物。然而,制约GLP-1成药的主要因素是其小分子多肽固有的高肾清除率和体内二肽基肽酶( dipeptidyl- peptidase,DPP)Ⅳ对于GLP-1特定位点的酶切。GLP-1的改造也集中在这2个方面。本研究中的GLP-1融合蛋白,是在GLP-1的基础上融合了“沉默抗体”IgG2σF c段,我们试图通过这样一种连接大分子蛋白的手段来降低GLP-1的肾清除率和免疫原性。同时,参考以往对
GLP-1(7-36)的改造,我们选择了A8G/G26E/R36G这样一种改造方式来避免DPP-Ⅳ对GLP-1的酶解。为了深入了解GLP-1-IgG2σFc融合蛋白在降低血糖、延长半衰期方面的可能性,我们构建了GLP-1融合蛋白的表达载体,并稳定转染CHO-K1细胞,用初步纯化出的融合蛋白在C57BL小鼠中进行了活性鉴定。
1 材料和方法
1.1材料
中国仓鼠卵巢细胞Kl(CHO-KI)由本实验室培养并冻存,使用GIBCO公司的CD-CHO液体培养基;大肠杆菌DH5a感受态细胞购于原平皓(天津)生物技术有限公司;真核表达载体SGLs由本实验室冻存于-800C冰箱;GLP-1融合蛋白表达序列由上海捷瑞生物- -程有限公司合成;HindⅢ和EcoR I限制性内切酶、T4DNA连接酶购白TaKaRa公司;快速琼脂糖凝胶DNA回收试剂盒.BCA定量试剂盒购自康为世纪生物技术有限公司;高纯度质粒小量快速提
取试剂盒购白博迈德生物技术有限公司;无内毒素中提质粒试剂盒购自MACHEREY-NAGEL公司;测序与引物合成南上海生L生物技术有限公司完成;辣根过氧化物酶标记的山羊抗人IgG( H+L)抗体购白中杉金桥公司;生物素标记的GLP-1抗体购自Thermo Fisher公司;L-蛋氨酸砜亚胺(L-methio-nine sulfoximine,MSX)和1xGS Supplement购自Sig-ma公司;Hi-Trap protein A层析柱购自GE Health-care;利拉鲁肽(liraglutide)购自诺和诺德公司。
1.2 GLP-1融合蛋白表达载体的构建
在设计的GLP-1融合蛋白序列两侧分别加入HindⅢ和EcoR I酶切位点,交上海捷瑞生物工程有限公司合成。用HindⅢ和EcoR I将GLP-1融合蛋白序列从合成的重组质粒pBluescriptⅡ上切下来,同时对SGLs U载体质粒行HindⅢ和EcoR I双酶切(酶切体系50 11L,包含HindⅢ1.5 VL,EcoR I1.5 μL,10x缓冲液2 5μL,10xBSA 5μL,质粒共约2μg,用ddH2O补足),对酶切产物行1%琼脂糖凝胶电泳,回收918( pBluescriptⅡ)和7528 b p( SGLs)核酸条带,用T4DNA连接酶将2片段连接成载体SGLs- GLP-1 -IgG2cr(载体和片段摩尔比为1:10,160C连接过夜),转化大肠杆菌DH5a感受态细胞,并将在LB培养基中活化的DH5a接种于LB固体培养基平板(含氨苄西林),于370C温箱内培养14 h后挑取菌落测序鉴定(引物为RW: 5'- GACTCGGGGCC GTTCATCA-3')。
1.3 GLP-1融合蛋白表达载体在CHO细胞中的稳定转染及亚克隆
用Pvu I对构建的载体SGLs- GLP-1-IgG2cr进行线性化处理(总体系100 VL,包含P vu I 5μL,10xK缓冲液10μL,10xBSA 10 μL,ddH_0 8poL,中提质粒SGLs-GLP-l-IgG2cr 67 μL约10μg);将线性化的质粒电转入CHO细胞(电转参数:电压300 V,电容900 μF,电击时间15.9 ms),电击后的细胞转至96孔板(每孔含培养基100 μL)继续培养24 h,后每孔补加150 μL培养基,使每孔培养基含有50 μL MSX和1xGS Supplement;经过20 d的培养,挑选长势好的单克隆孔转移至含1mL培养基的24孔板中,7d后选取优势单克隆孔转移至小摇瓶中培养(4 m L培养基加入1 m L细胞),5d后根据表达量和细胞状态择优扩大至大摇瓶中(26 m L培养基加入4 m L细胞),培养5d后细胞冻存留作后续细胞株筛选用;筛选时,用间接ELISA相对定量(1:10000,辣根酶标记的山羊抗人Ig G抗体)和SDS-PAGE对细胞培养上清进行检测,综合结果选取高表达细胞株进行亚克隆;经亚克隆筛选后,最终挑选2G11细胞株进行后续试验;将2G11细胞株在大摇瓶中连续培养14 d,每天取培养液上清100μL做SDS-PAGE检测和间接ELISA相对定量,确定连续培养时间。
1.4 GLP-1融合蛋白的初步纯化
2GI1细胞株连续培养12 d后收集上清,利用GLP-1融合蛋白含有的IgG Fc段进行初步Protein A亲和层析(纯化体系:pH7.4的10 m mol/L PBS平衡液,pH3.0的50 m mol/L柠檬酸缓冲液,pH9.0的Tris- HCl中和液),50 m mol/L柠檬酸缓冲液10 min梯度洗脱,并迅速用Tris -HCl中和液对洗脱的蛋白进行中和,用超滤管对蛋白超滤浓缩并用10 m mol/L pH7.4的PBS对溶媒进行替换,使用BCA定量试剂盒对超滤浓缩后的蛋白进行定量。
1.5 GLP-1融合蛋白的鉴定
对纯化后的融合蛋白(200 n g)行SDS-PAGE,将2块胶上的蛋白转移至2张硝酸纤维素膜上,用PBST(含5%的脱脂奶粉)封闭1 h,分别用辣根过氧化物酶标记的山羊抗人Ig G(H+L)(1.5000)抗体和生物素标记的GLP-1抗体(1: 5000)孵育2h,用TBST对硝酸纤维膜清洗6次,生物素标记的GLP-1抗体处理的膜再使用链霉亲和素标记的辣根过氧化物酶(1:100 000)孵育处理1 h,清洗6次后,加入底物发光液(TMB)进行曝光显影。
1.6 GLP-1融合蛋白在C57BL小鼠中的降血糖作用
30只8周龄C57BL雄性小鼠,初始血糖差异不显著,按照单因素完全随机试验设计随机分为5组:6 mg/kg GLP-l-IgG2σ试验组(相当于100 n mol/kg)、1.5 mg/kg GLP-l-IgG2σ试验组(相当于25 n mol/kg)、0.3 mg/kg GLP-I-IgG2σ试验组(相当于5 n mol/kg)、0.1 mg/kg利拉鲁肽(相当于25 n mol/kg)阳性药组、阴性对照组(生理盐水)。口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)前小鼠适应1周,试验前空腹14 h,并在葡萄糖(1.5 g/kg)灌胃前30 min腹腔给药处理。灌胃后的0、10、20、30、60、90 min取小鼠尾尖血测血糖,并观察期间小
鼠的状态。
2结果
2.1 GLP-1融合蛋白重组质粒的构建及鉴定
对合成基因的重组质粒pBlues criptⅡ和表达载体质粒SGLs行HindⅢ和EcoR I双酶切,核酸电泳图显示pBlues criptⅡ被剪切为918和2948 b p两条片段,而SGLs载体被剪切为428和7528 b p两条片段(图1A)。用T4 DNA连接酶将918 b p的GLP-1融合蛋白表达片段和7528 b p的表达载体片段连接,转化大肠杆菌D H5a后挑取在含氨苄西林的LB平板上生长的阳性转化菌落进行测序,结果显示成功构建了GLP-1融合蛋白表达载体(图2)。用无内毒素质粒提取试剂盒提取表达质粒并进行线性化处理(图1B),用于下一步的稳定转染,结果显示线性化后质粒大小约为8000 b p。


2.2 GLP-1融合蛋白稳定细胞株的建立
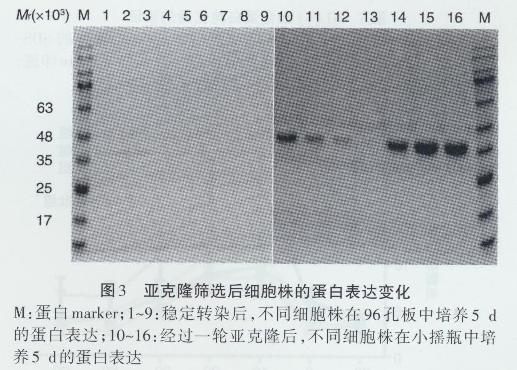
通过比对最初转染96孔板上的细胞培养5d的上清和经过一轮亚克隆后的细胞培养5d的上清的蛋白SDS-PAGE结果,显示稳定转染的CHO细胞株可以稳定表达GLP-1融合蛋白(还原蛋白实际M r为36x103),并且经过一轮亚克隆后细胞株的蛋白表达量明显上升(图3)。最后对筛选出的高表达细胞株2GI1进行为期14 d的连续培养,结果显示(图4)细胞株的蛋白表达量逐日增加,在第13 d时非目的蛋白条带大量出现,故选择连续培养至12 d时收取细胞培养上清。

2.3 GLP-1融合蛋白的初步纯化
GLP-1融合蛋白含有IgG2σ的F c段,因此我们采用Protein A亲和层析的方法对细胞上清进行蛋白纯化,通过对蛋白梯度洗脱,发现在洗脱液比例达到40%时蛋白即被洗脱下来,故在后续的纯化洗脱步骤均使用40% pH3.0的50 m mol/L柠檬酸缓冲液。洗脱的蛋白超滤浓缩后行SDS-PAGE,结果显示目的蛋白还原处理后单链M约为36x103。为了弄清GLP-1融合蛋白完整结构是否具有Ig G段和GLP-1段,用Western印迹检测了经非还原处理的完整二聚体融合蛋白,结果显示完整的GLP-1融合蛋白可以同时被针对Ig G和GLP-1的抗体检测到,M r约为60x103。见图5。
2.4 C57BL/6J小鼠的OGTT
对C57BL/6J小鼠进行OGTT后,结果显示高、中、低剂量的GLP-1融合蛋白同阳性药利拉鲁肽一样均显示出显著的降血糖作用(图6A),各组GLP-1融合蛋白和阳性药利拉鲁肽在120 min的OGTT过程中的血糖曲线下面积均显著小于PBS组,但高剂量GLP-1融合蛋白的降糖作用并非显著优于中剂量,这也提示在进一步试验中应当降低蛋白药物的高、中剂量(图6B)。综上所述,初步认为构建表达的GLP-1融合蛋白具有降低血糖的生物活性。
3讨论
Ⅱ型糖尿病是一种以胰岛素相对不足和胰岛素抵抗为特征的慢性疾病,是糖尿病的主要类型,Ⅱ型糖尿病人群占糖尿病患病人群的90%以上。目前糖尿病的主要治疗药物为双胍类药物、噻唑烷二酮类药物、磺脲类药物、基础胰岛素、DPP-Ⅳ抑制剂和GLP-1受体激动剂。传统的糖尿病治疗药物有低血糖、增加体重等副作用,而GLP-1受体激动剂具有血糖依赖性降血糖和控制体重的作用,因此该研究领域得到高度关注。但GLP-1的2种天然活性形式GLP-1 (7-37)和GLP-1( 6-37)为小分子多肽,易被肾排出,并且被体内DPP-Ⅳ特异性酶解,故GLP-1受体激动剂的研发全都集中在增大GLP-1分子及酶切位点的替换和遮蔽上。
在本研究中,我们采用融合蛋白的方式将GLP-1变体与IgG2σ的Fc段通过连接肽连接,在极大地提高了GLP-1的相对分子质量的同时,还进行了同GLP-1受体激动剂利拉鲁肽(2014年美国FDA批准上市销售)一样的氨基酸位点替换( A8GIG26EIR36G)。其中应用的IgG2σ为一种“完全沉默”抗体,研究显示IgG2σ相对于以往常用于融合蛋白的IgG (IgG2m4、IgGI、IgG4 ProAlaAla)具有最小的免疫原性。我们期望这样一种GLP-1融合蛋白可以在保持GLP-1生物活性的同时延长半衰期。
构建好GLP-1融合蛋白表达质粒后,我们采用哺乳动物细胞CHO稳定转染方式表达融合蛋白。一方面可以有效地对高表达细胞株进行筛选从而获得大量蛋白用于后续试验,另一方面在哺乳细胞中表达的蛋白相较于其他表达平台可以最大程度地接近人源构象。通过一轮亚克隆后的稳定细胞株的融合蛋白表达量达到1g/L的水平,为后续试验提供了蛋白量的保证。目前本实验采用的纯化方式为Protein A亲和层析,理论上可以有效地提取出所有带IgG2σF c段的融合蛋白。但是结合Western印迹和SDS-PAGE结果,发现细胞表达的产物可能还存在多聚体的情况,故还须进一步摸索纯化方法,以获得单一的GLP-1融合蛋白。
GLP-1受体激动剂降血糖作用具有血糖依赖性,根据相关文献,我们设计在腹腔给予高、中、低剂量的GLP-1融合蛋白30 min后进行口服葡萄糖耐量试验,结果显示融合蛋白可以显著降低餐后血糖。根据血糖变化情况和AUC得出以下结论:融合蛋白在1.5 mg/kg时即已达到最大有效剂量,可以初步看出血糖的控制情况具有剂量依赖性,并且与阳性对照药利拉鲁肽,相比,小鼠体内降糖作用具有非劣性。
根据以上研究结果,我们认为GLP-1融合蛋白具有GLP-1受体激动剂的降糖作用,且细胞株的筛选方式和初步纯化方法具有可行性,为后续的体内、体外活性研究和纯化方法确定提供了基础,同时也可为相关的融合蛋白研究提供参考。
上一篇:雨水管渠人廊设计要点探讨
下一篇:返回列表