陈贤1,2,邓志平2,董岩3,严成其2,陈剑平1,2
1.浙江大学农业与生物技术学院,浙江杭州310029;2.浙江省农业科学院病毒与生物技术研究所,浙江杭州310021;3.南京农业大学植物保护学院,江苏南京210095
[摘要] 目的:在大肠杆菌中融合表达水稻蛋白OmR40cl,并探讨其与红细胞的凝集效果,为进一步研究OmR40cl在体外的抑菌实验做准备。方法:PCR扩增目的基因,经BamH I及NotI双酶切,连入表达载体pCEX-6p-1构建成重组质粒,测序正确后转入大肠杆菌BL21,优化诱导表达条件;纯化重组OmR40cl蛋白,并分析其与红细胞的凝集效果。结果:获得原核表达的OmR40cl蛋白,重组OmR40cl在低温(4qC)条件下可与兔血红细胞发生凝集作用。结论:原核表达体系适合水稻OmR40cl蛋白的融合表达。
[关键词] 水稻凝集素;OmR40cl;原核表达;凝集效果
[中图分类号] Q78; R392.1[文章编号] 1009-0002( 2016) 02-0168-05
凝集素是一类对红细胞具有凝集活性的蛋白或糖蛋白的总称,广泛分布于动物、植物和微生物中。自1884年Stillmark首次发现蓖麻凝集素以来…,已有多达1000多种植物凝集素被发现。植物凝集素是一类防御蛋白,在抗虫、抗真菌、抗细菌等方面扮演着非常重要的角色。转GNA(Galanthus n,ivalisagglutinin,雪莲花凝集素)阳和PTA(Pinellia ternataagglutinin,半夏凝集素)的水稻分别对白背飞虱和褐飞虱具有明显的毒杀作用;稻瘟菌抗病基因Pi~d2编码的蛋白是一个凝集素受体激酶;狗脊蕨凝集素分别对金黄色葡萄球菌、玉米大斑病菌、甘薯薯瘟病菌等具有很强的抑制作用。
水稻中有125个凝集素基因和174个凝集素受体激酶基因。水稻凝集素在水稻胚胎发育、植株发育及抗病…I过程中可能扮演着非常重要的作用。目前,有关水稻凝集在水稻防御病原细菌中的研究报道较少。前期,我们通过2D DIGE-MS(荧光双向电泳一质谱技术)发现一个响应白叶枯病菌侵染的疣粒野生稻凝集素蛋白OmR40cl,与Ricin_B同源。在本研究中,我们将谷胱甘肽S转移酶( glutathi-one S-transferase,GST)与OmR40cl蛋白融合表达,利用GST层析法快速分离纯化OmR40cl-GST蛋白,通过体外红细胞凝集实验,验证OmR40cl是否具有凝集作用,为下一步研究OmR40cl的体外抑菌实验和有关OmR40cl是否参与水稻识别白叶枯病菌的侵染前期做准备。
1 材料与方法
1.1 材料
原核表达菌株大肠杆菌BL21购自北京全式金生物科技有限公司;大肠杆菌DH5a由本实验室保存;原核表达载体pGEX-6p-l、填料和预装柱购自GE Healthcare Life Science公司;克隆载体pMD19-T Blunt Simple购自TaKaRa公司;高保真聚合酶KOD- FX购自TOYOBO公司;限制性内切酶购自NEB公司;T4DNA连接酶购自TaKaRa公司;胶回收和质粒提取试剂盒购自康为世纪公司;SDS-PAGE所用化学试剂购白Amresco公司;蛋白分子量mark-er购自Fermentas公司;GST单克隆抗体购自Abmart公司;碱性磷酸酶标记二抗购自Sigma公司;PVDF购自Bio-Rad公司;半干转移槽购自Bio-Rad公司。
1.2 0mR40cl-GST融合表达载体的构建
根据RGAP(Rice Genome Annotation Project,http://rice.plantbiology.msu.edu/index.shtml)中公布的R40cl( Os03921040.2)的核苷酸序列,设计带有酶切位点的基因全长引物F-5 7(BamH I)GGATCCATGTTCGGCTTCGGGCACCAC3'和R-5 7(NotI)GCGGCCGCTTACCAGGGGACGATCTTCCA3,。 以本实验保存的pjET-OmR40cl为模板,在KOD-FX高保真聚合酶作用下进行PCR扩增(PCR反应流程:940C预变性2 min;94℃变性30 s,58℃退火30 s,68℃延伸90 s,共35个循环;68℃延伸8 min)。PCR产物经
1.5%琼脂糖凝胶电泳后回收并纯化得到OmR40cl片段,将其连接到pMD19-Tsb载体中,转化大肠杆菌DH5a,经菌液PCR检测为阳性后送博尚生物测序公司进行序列检测。
将测序正确的pMD19- Tsb- R40cl和载体pGEX-6p-l分别用限制性内切酶Bam H I和Not I
酶切,经琼脂糖凝胶电泳,切胶纯化回收,将回收片段和载体混合后,在T4DNA连接酶作用下于16℃反应3h,将连接产物导人大肠杆菌DH5a,菌液PCR检测阳性后测序,将测序正确的OmR40cl-GST质粒导人大肠杆菌BL21,菌液PCR检测为阳性的菌株作为下一步表达菌株。
1.3 融合蛋白的诱导表达
挑取带有OmR40cl-GST的BL21单克隆于装有LB液体培养基(含100 μg/m L氨苄西林)的1.5 m LEP管中,37℃振荡过夜培养,按1:100的比例将菌液转接到5 m L(共6组)新鲜LB培养基(含100 μg/m L氨苄西林)中,37℃振荡培养2h至D600nm值约为0.6,
从菌液中取出1mL作为阴性对照组,在余下的菌液中添加IPTG(终浓度分别为0.1、0.4、0.7 m mol/L),并分别于37℃、30℃振荡培养5 h;从菌液中取1 m L作为实验组,8000 r/min离心3 miri收集菌体,向菌体中添加100μL缓冲液(50 m mol/L Tris- ClpH6.8,100 m mol/L DTT,2% SDS,0.1%溴酚蓝,10%甘油)重悬菌体,然后在液氮中反复冻融3次,13 000 r/min离心10 min,转移上清液,再次用100μL缓冲液重悬沉淀,按比例向上清液和沉淀中添加
4×上样缓冲液,在沸水中孵育约10 min,13 000 r/min离心10 min,分别取10μL行12.5% SDS-PAGE及Western印迹。
1.4融合蛋白的纯化与鉴定
按照1.3所述步骤大量诱导OmR40cl-GST蛋白表达,并用超声波细胞破碎仪破碎细胞,12 000 r/min离心20 min,转移上清液。在预装柱中纯化OmR40cl-GST蛋白:向预装柱的进料口缓慢注射8m L PBS缓冲液(140 m mol/L Na Cl,2.7 m mol/LKCl, 10 m mol/L NaZHP04, 1.8 m mol/L KH2P04,pH7.3),吸取50 m L上清液,在鲁尔接头作用下缓慢经过预装柱,接着吸取10 m L PBS缓冲液缓慢清洗柱子,用洗脱缓冲液(50 m mol/L Tris-HCl,还原型谷胱甘肽,pH8.0)将柱内的OmR40cl-GST洗脱下来。将OmR40cl-GST蛋白溶液转移至透析袋中,并浸润在PBS缓冲液中透析4h,最后利用PEG20000去除样品中的水分,进行12.5% SDS-PAGE检测。
1.5融合蛋白的红细胞凝集实验
采取兔子静脉处血浆10 m L,缓慢注入带有1m L柠檬酸钠(3.8%)的50 m L无菌EP中,向管中加4 m L生理盐水,水平轻微混匀,1500 r/min离心5 min;重复生理盐水清洗血红细胞共计5次;利用红细胞压积制成2%的红细胞悬浮液,分别向96孔板(5组×12梯度)中60个孔中各添加25μL生理盐水,将OmR40cl-GST蛋白溶液(1 mg/m L)按1/2梯度稀释,从第1孔一直添加到第12孔,GST(I mg/m L)、PHA(phytohemagglutinin,植物凝血素)(1 mg/
m L)及PBS溶液的添加方式与OmR40cl-GST基本一样,然后向每组的12个梯度中分别添加25 μL红细胞悬浮液,水平晃动后分别置于37℃及4℃约15min,观察凝集效果,计算凝集效价。
2结果
2.1 0mR40cl-GST融合表达载体的构建
提取目的基因测序正确的pMD19-Tsb- R40cl质粒,用BamH I和NotI双酶切,获得OmR40cl片段。pGEX-6p-l原核表达载体也经同样双酶切处理,获得线性载体。将载体和目的片段连接后导人大肠杆菌DH5a细胞(图1),获得OmR40c1-GST重组质粒。提取目的基因,将测序正确的OmR40cl-GST质粒导人大肠杆菌BL21原核表达细胞,挑取菌液进行阳性检测(图2)。


2.2 0mR40cl-GST融合蛋白的诱导表达
温度和IPTG浓度是影响融合蛋白表达的两大关键因素。为了确定融合蛋白OmR40cl-GST的诱导条件,重组菌株分别在2个温度( 37℃、30℃)和3个IPTG浓度(0.1、0.4、0.7 m mol/L)条件下进行诱导表达。结果表明(图3),IPTG浓度为0.1 m mol/L时OmR40cl- GST蛋白表达量最高,IPTG浓度为0.7m mol/L时蛋白表达量最低;温度基本不影响OmR40cl-GST融合蛋白的表达。

2.3 0mR40cl-GST融合蛋白的Western印迹验证
OmR40Cl-GST融合蛋白表达载体通过小量诱导表达实验后,确定诱导条件为0.1 m mol/L IPTG、37℃下诱导表达5h。将诱导前后的菌液裂解后,提取上清蛋白进行Western印迹,结果如图4,空载体pGEX-6p-l诱导表达的M r为28.43x103的蛋白能被GST单抗特异识别,且与理论M r一致,说明该蛋白即为GST标签蛋白;pGEX-6p-l-OmR40cl诱导表达的M r为69.71x103的蛋白也能被GST单抗特异识别,且与理论M r一致,说明该蛋白即为OmR40cl-GST
融合蛋白。

2.4 0mR40cl-GST融合蛋白的纯化
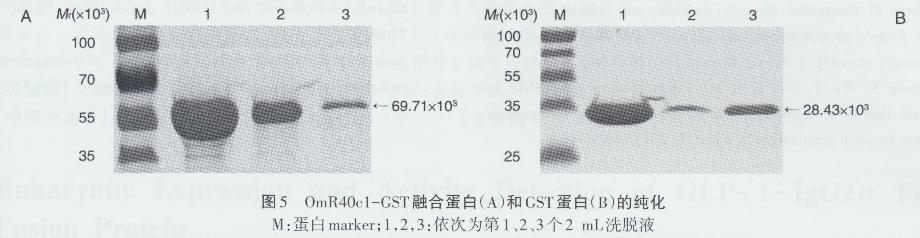
OmR40cl-GST融合蛋白通过适宜条件诱导表达后,将重组菌经超声波破碎及离心,获得上清液,通过亲和层析分别获得OmR40cl- GST和GST蛋白。为了检测亲和层析的洗脱情况,分别吸取15μL的第1、2及3个2 m L洗脱液进行SDS-PAGE检测,结果如图5,OmR40cl-GST和GST均被纯化,且第1管洗脱液的蛋白浓度最高。
2.5 0mR40cl-GST融合蛋白与红细胞的凝集作用
将OmR40cl-GST、GST、PHA(浓度均为1 mg/m L)及PBS缓冲液分别与兔红细胞反应,结果如图6。在4℃时只有OmOmR40cl-GST和阳性对照PHA与兔红细胞有凝集沉降作用,而在37℃时只有PHA与兔红细胞有凝集沉降作用。可以看出OmR40cl具备凝集红细胞的功能,是一种水稻凝集素,并且其凝集效价随着温度的降低而增强。

3讨论
凝集素在植物生长发育、抗盐、抗真菌及抗虫等生命活动中扮演重要的角色。自1936
年Sumner分离纯化了第一个植物凝集素ConA(刀豆凝集素)以来,对植物凝集素的性质、分子结构及功能的研究取得了很大进展。
本研究中,我们采用原核表达体系诱导表达OmR40cl-CJST融合蛋白。为了最大量获得具有生物活性、可溶性的OmR40cl-GST,我们优化了诱导温度和IPTG浓度,使得OmR40cl-GST融合蛋白大量表达于细胞裂解后的上清里。我们利用亲和层析纯化OmR40cl-GST融合蛋白,经过洗脱、透析后,最终获得了纯度较高、特异性较强的OmR40cl-GST融合蛋白。
用标签GST蛋白和OmR40cl-GST融合蛋白对兔红细胞进行凝集素血凝试验,发现OmR40cl在4℃下具有凝集红细胞的特性,而在37℃时丧失凝集作用。OmR40cl的凝集效价为0.125 mg/m L对应2%兔红细胞。对OmR40cl凝集素的表达与纯化,为研究OmR40cl的体外抑菌实验,以及OmR40cl是否参与水稻识别白叶枯病菌的侵染奠定了基础。
上一篇:深港西部通道深圳侧接线工程隧道结构盖挖半逆作法设计与施工特点
下一篇:返回列表