作者:郑晓敏
益生菌要发挥其保健功能,必须满足三个条件:其一,益生菌必须是活的;其二,益生菌含量必须达到l06 CFU/m L以上才能达到保健功效,益生菌乳制品活菌数量要求不得低107 CFU/m L才能补偿益生菌在通过人体胃肠道时活菌数的损失;其三,益生菌的功效和益处必须是经过临床验证的。发酵乳被认为是益生菌传递到人体内的最理想载体。益生菌的品种、数量和活力是影响发酵乳制品的保健功能和营养物质的基础。GB 19302-2010“食品安全国家标准发酵乳”中允许风味发酵乳使用食品添加剂。试验拟采用牛津杯法测定37种食品添加剂对干酪乳杆菌、嗜酸乳杆菌、长双歧杆菌、婴儿双歧杆菌和两歧双歧杆菌五种益生菌的抑菌活力和最小抑菌浓度,旨在为发酵乳生产中益生菌的活力和数量控制提供试验依据。
1 试验材料与设备
1.1培养基
MRS琼脂:青岛海博生物技术有限公司。
1.2菌株
干酪乳杆菌(Lactobacillus casei,简称LC)ATCC334;嗜酸乳杆菌(Lactobacillus acidophilus,
简称LA)GIMl.208;长双歧杆菌(B/f/dobacteriumlongum,简称BL)GIMl.248;婴儿双歧杆菌(Bidobacterium infantis,简称BI)FSCC 118003;两歧双歧杆菌(Bifidobacterium b/f/dum,简称BB)FSCC118001。
1.3添加剂
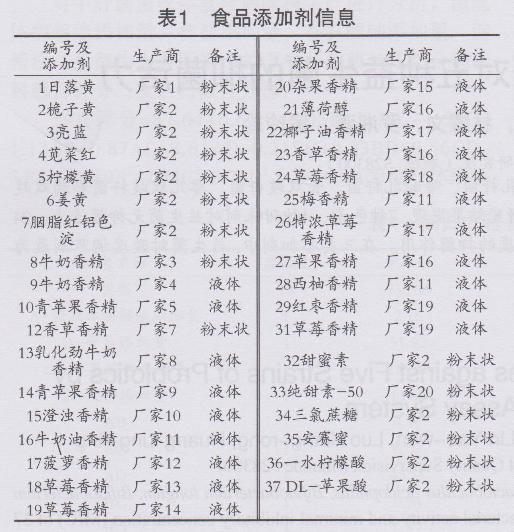
试验选择7种色素、24种甜味香精、4种甜味剂、2种酸度调节剂共37种食品添加剂进行抑菌活力试验,其信息见表1。
1.4仪器和设备
Easymix拍击式均质器:AES Chemunex公司;高压蒸汽灭菌器:ALP公司;麦氏比浊仪:BioM 6 rieux:牛津杯(内径6.0±0.1 mm,外径7.8±0.1mm,高10.0±0.1 mm):武汉药科新技术开发有限公司;AC2-6S1生物安全柜:新加坡ESCO公司;MS3漩涡混合仪:IKA公司。
2 牛津杯法测定添加剂对益生茵的抑茵活力
2.1抑菌液的配制及倍比稀释
粉末状添加剂:称取一定质量的添加剂,无菌水溶解,定容至100 m L,摇匀,制成10.000 g/100 m L母液;液体添加剂以100.000%原液作为母液。4℃保存备用,使用前摇匀。
倍比稀释:粉末状添加剂取7支EP管,每管加入5.000 m L无菌水,在第1管加入5.000 m L母液,混匀,吸取5.000 m L混合液至第2管,混匀,再吸取5.000mL混合液至第3管,如此反复操作直至第7管,制成5.000, 2.500, 1.250, 0.625, 0.313, 0.156和0.078g/100 m L系列浓度。同法液体状添加剂制成50.000%,25.000%, 12.500%, 6.250%, 3.125%, 1.563%,0.781%和0.391%系列浓度。
2.2指示菌悬液的制备
益生菌接种于MRS培养基,36℃±1℃厌氧培养48 h,用无菌生理盐水制备2.40~2.60麦氏比浊度(约106 CFU/m L)菌悬液,立即用于抑菌试验。
2.3检测平板的制备
每个平板加入20 m L MRS琼脂,凝固后待水分干燥,取0.2 m L菌悬液在平板上均匀涂布,以平板无可见水滴为准,立刻进行抑菌试验。
2.4抑菌圈测定
以无菌水为空白对照,每个平板均匀放置3~4个牛津杯,每个牛津杯加入200 VL抑菌液,36℃±1℃下厌氧培养48 h。观察牛津杯底周围有无抑菌圈,每次试验作3次平行,测量抑菌圈直径,取平均值。
2.5最小抑菌浓度(MIC)的测定
先以母液做初筛试验,根据初筛结果,挑选出有抑菌圈的添加剂继续研究。用牛津杯法测定其MIC,能产生抑菌圈的最小的浓度定为MIC。其确定标准为:在该浓度下抑菌圈直径大于或等于8.0 mm。
3结果与分析
3.1添加剂的初筛结果
以母液作为初筛浓度,测试37种添加剂对五种益生菌的抑菌活力,结果如表2所示。


从表2可以看出,在37种添加剂中,1~7号7种色素,8,9,11,12和15号5种香精,32~35号4种甜味剂,这16种添加剂在初筛浓度下对五种益生菌均不产生抑菌圈,表明其无抑菌活力。其他添加剂对一种或以上益生菌产生不同程度的抑菌作用。抑菌活力试验
在培养过程中,添加剂从牛津杯底向MRS琼脂扩散渗透,通过对益生菌的抑杀作用而影响其生长繁殖,使菌落形成抑菌圈,依抑菌圈的大小确定添加剂抗菌能力的强弱。试验结果显示,抑菌活力由强至弱为:酸度调节剂>香精>色素=甜味剂。选择有抑菌圈产生的添加剂继续研究。
3.2色素、甜味剂对益生菌的抑菌活力
当牛津杯内加入添加剂溶液后,即产生两种互动因素:一是添加剂溶液向培养基内呈球面形扩散;另一种是益生菌开始生长。添加剂在MRS琼脂培养基内的浓度,随离牛津杯外径距离的增大而降低,离牛津杯外径越远,MRS培养基中添加剂浓度越低,当添加剂扩散到一定时间,添加剂浓度高于最小抑菌浓度( MIC)的范围内,益生菌的生长受到抑制,形成透明抑菌圈,圈之边缘处恰好为添加剂MIC。从表2可以看出,色素和甜味剂在初筛浓度10.000 g/100 m L下,均无抑菌圈产生。此浓度下,色素已是过饱和溶液,说明色素和甜味剂对五种益生菌无抑菌活力。
根据GB 19302-2010“食品安全国家标准发酵乳”和GB 2760-2011“食品安全国家标准食品添加剂使用标准”,发酵乳中允许使用柠檬黄、日落黄、咽脂红、亮蓝、安赛蜜和三氯蔗糖。各添加剂在乳制品或者近似食品类别中的最大使用量见表3。色素和甜味剂的初筛浓度远远大于最大使用量,而实际应用中,出于生产需要和成本考量,实际使用量又远远低于最大使用量。说明在使用范围内,7种色素和4种甜味剂对益生菌无抑制作用。

3.3香精对益生菌的抑菌活力
19种通过初筛的甜味香精的MIC测定结果见于表4。
由表2和表4可看出,24种甜味香精中,有19种对一种或以上益生菌产生了不同程度的抑制作用。其中,18草莓香精,19草莓香精,26特浓草莓香精,30酸奶香精对益生菌的抑菌活力较强。MIC越小,说明其抑菌活力越高。对LC、LA、BL、BI和BB的抑菌活力最高的分别是30,19,26,26和26,其对应的MIC分别为3.125%, 3.125%,1.563%,6.250%和6.250%。由表3可知食用香精在食品中是按生产需要适量添加,一般添加量在0.01%~0.5%之间。试验结果表明多种香精对益生菌的MIC较为接近实际应用量,可能会影响发酵乳制品中益生菌的存活力。
香精是由各种酸、醇、醛、酮、酯类等组成的混合物,一般含有二三十种化学成分。如调配型草莓香精主要含有乙醇、丙二醇、草莓醛、麦芽酚、香兰素等成分。发酵型酸奶香精主要含有丁酸、己酸、壬酸、肉桂酸、癸酸、十二酸、十四酸、十六酸等具有酸奶香味的复合有机酸。不同香精组成成分差别很大,同一风味的香精由于制备工艺不一样,采用合成香料调配或微生物发酵或酶解法制备,其成分也存在很大差异。香精的抑菌活力作用成分和机理尚待进一步研究。
3.4酸度调节剂对益生菌的抑菌活力
两种酸度调节剂的MIC试验结果见表5。
由表5可知,相对其他两类添加剂,两种酸度调节剂对益生菌均产生的抑菌活力最强。抑菌机理可能是低pH环境抑制了益生菌的正常生长繁殖。10.000 g/100 m L-水柠檬酸溶液的pH低至1.69,严重抑制了益生菌的生长,随着浓度的稀释,其pH逐渐上升,其抑菌活力也逐渐降低。0.625 g/100 m L溶液的pH为2.41, 0.313 g/100 m L溶液的pH为2.59,益生菌均在pH2.5左右生长受到抑制。DL-苹果酸也可能是由酸性环境导致的抑菌作用。益生菌比乳酸菌更为耐酸,其最适pH为5.5左右,但在肠道(pH 3.O左右)或胆汁中仍具活性,并可定殖于肠黏膜,发挥益生作用。研究结果表明,一水柠檬酸和DL-苹果酸对益生菌的MIC为0.313和0.625 g/100 m L。即益生菌的最低生长pH范围在2.41~2.59之间。益生菌对二者溶液酸度的变化较为敏感。


4结论与展望
通过初筛试验,从37种添加剂中挑选出21种有抑菌活力的添加剂。研究结果表明,酸度调节剂对益生菌的抑菌活力最高,香精其次,色素和甜味剂无抑菌活力。甜味香精中,对LC、LA、BL、BI和BB的抑菌活力最高的分别是30,19,26,26和26,其对应的MIC分别为3.125%,3.125%,1.563%,6.250%和6.250%。益生菌对酸度调节剂最敏感,一水柠檬酸和DL-苹果酸对五种益生菌的MIC为0.313和0.625 g/100mL。添加剂对益生菌的抑菌机理尚不清楚,不同类别的添加剂抑菌机理可能不同,仍需进一步深入研究。有抑菌活力的添加剂对发酵乳或其他发酵乳制品发酵过程中和货架期中益生菌的生长繁殖和存活力的影响也需进一步研究验证。
5摘要采用牛津杯法测定了37种食品添加剂对干酪乳杆菌、嗜酸乳杆菌、长双歧杆菌、婴儿双歧杆菌和两双歧杆菌五种益生菌的抑菌活力和最小抑菌浓度(MIC)。研究结果发现,7种色素、4种甜味剂对益生菌无抑茵活力。24种甜味香精中有19种对一种或以上益生菌产生不同程度的抑菌作用。在三类添加剂中,益生菌对酸度调节剂最为敏感。
下一篇:返回列表